|
はじめに
軟部組織の増大術は、先天性・後天性陥凹変形の修正に加え、豊胸など純粋に美容的改善を目的として行われる治療法で、形成外科、美容外科領域では非常に需要の大きい治療の一つである。具体的には、癌切除後の陥凹変形、外傷後の陥凹変形、漏斗胸や片側顔面萎縮症(hemifacial
microsomia)などの先天性疾患、さらに純粋な美容目的では、豊胸術、隆鼻術、オトガイ増大術、頬・側頭部・上下眼瞼などの加齢性陥凹などへのニーズが高い。
軟部組織の増大目的には、従来から遊離脂肪移植(脂肪注入術、真皮脂肪複合移植)、血管柄付き脂肪弁移植、血管柄付き筋皮弁移植、人工物の挿入術・注入術などが行われてきた。組織の増大が“注入治療”により実現できれば、瘢痕も残さず、形態改善の自由度も高い。人工物の注入剤では、古くはパラフィン、オルガノーゲン、シリコンジェルなどが使われたが異物反応をはじめ悲惨な後遺症を残す結果となった。現在、牛コラーゲン、ヒトリコンビナントヒアルロン酸、ポリ乳酸などが使われるが(我が国では牛コラーゲン以外は未承認)、いずれも吸収性材料であるため安全性は高いが、治療効果は一時的に過ぎない。一方、自家脂肪注入術はやはり古くから行われているが、移植脂肪は大半が壊死に陥り、治療効果が悪い上に、石灰化や線維化などの後遺症も見られ、決して満足できるものではなかった。近年、この脂肪注入法が見直され、様々な工夫により生着率が高くなった。我が国ではまだ認知度は低いが、今後再生医療技術を含めたさらなる移植技術の進歩が期待されている。自家脂肪注入の優れている点は、①自家組織であるためアレルギー、拒絶などの問題点がない、②移植材料の採取・移植行為ともにすべて針やカニューレで行われるために瘢痕を(ほとんど)残さない、③移植に際して形態修正の自由度が高い、④生着すれば軟部組織本来の柔らかさ、弾性、質感がある、⑤生着したものは残るので治療効果は一時的ではなく持続する、⑥カプセル拘縮などの異物反応による術後変形がない、などである。
脂肪組織由来の幹細胞
近年、脂肪組織内においても未分化な多能性細胞が存在することが明らかになった[1-5]。脂肪組織の間質には未分化な細胞群が存在し、従来から脂肪前駆細胞preadipocyte、血管-間質系細胞vascular-stromal
cell、線維芽細胞様細胞fibroblast-like cellなどとさまざまな呼び名で呼ばれていたが、ここでは脂肪由来の間質細胞ということでadipose-derived
stromal cell (以下ASC)と呼ぶ。ASCの一部に単一クローンから多方向に分化する幹細胞が確認され、脂肪、軟骨、骨、骨格筋、心筋、腱、神経、血管などへ分化誘導できる可能性が示されている(図1)。ASCは、成熟脂肪細胞間に接して存在しており、さらに脂肪組織内の結合組織内にも多数存在する。
吸引脂肪内のASCはPLA(processed lipoaspirate)cellと呼ばれていたが[2,3]、我々は脂肪吸引手術で得られる吸引物の中の脂肪部分だけでなく廃液部分からも相当数のASCが得られることを明らかとした。脂肪部分から取れるASCと同様の細胞群と考えられる。このように吸引脂肪は機械的な破砕、その後の内因性酵素反応などによりASCの一部が失われており、そのことが吸引脂肪の移植時の生着率を落としている原因の1つであると思われる。ASCはCD13、29、31(一部)、34、44、45(一部)、49d、54、58、71、73、90、105、106、117(一部)、146(一部)、151、SH3を発現しており、CD3、4、14、15、16、19、33、38、56、61、62e、62p、69、104、135、144が陰性である。分化誘導培地で培養すれば2-3週間で骨、軟骨、脂肪など臓器特異的な蛋白の発現が認められる。CD31、34、45、106、117などは培養期間が長くなると発現が無くなっていく。ヒト真皮由来培養線維芽細胞との違いは、線維芽細胞では多くの細胞でCD56が発現しているが、ヒト脂肪由来培養細胞群には見られない。逆に皮膚線維芽細胞ではCD34、71、105などの発現があまり見られない。一方、骨髄由来間葉系幹細胞ではCD34の発現が少なくCD49dの発現が通常は見られないという相違点がある。
脂肪注入による組織増大術へのASCの応用
脂肪注入術において移植材料となる吸引脂肪は上述のごとくADSが部分的に失われた組織であり、そのADSを移植時に補填することにより、移植組織の定着率を高めようとする試みを我々は行っている。組織の生着・維持のためには前駆細胞の存在が必須であり、移植組織の前駆細胞が不足していれば、その組織の生着には不利である。ADSは間葉系幹細胞としての性質を少なくとも部分的には維持しているとともに[2-6]、血管内皮細胞への分化や血管新生に寄与することが報告されている[7,8]。
ASCを、脂肪吸引により採取された破砕脂肪と混合して移植すると、破砕脂肪の単独移植に比べて、血管新生が強く、移植脂肪も大きく成長することがSCIDマウスとヒト脂肪を使った我々の実験で明らかとなっている(図2,3)。我々のGFPラット由来ASCを用いた混合移植研究では、移植後にASCが間質中にASCとして存在したり血管内皮細胞に分化していることが明らかになっている(図4)。我々は現在この治療効果は臨床でも検証を行っている。脂肪細胞への分化はまだ確認されていないが、移植組織の生着に欠かせない血管新生や前駆細胞ストック補充に寄与することにより、混合移植の有効性に繋がっていると考えられる。すでに臨床試験を始めており症例を重ね長期的評価を待って報告する予定である。
脂肪は血管が豊富な組織であり、脂肪再生と血管新生は切っても切れない関係にあることはこれまでにも多くの研究で示唆されている。ASCは、さらに心筋梗塞、肝再生、血管新生への効果もin
vivoの動物実験で示唆されており、脂肪注入移植同様に臨床応用が検討されている。我々も糖尿病マウスを用いた研究で皮膚潰瘍の創傷治癒をASCが大きく改善することを確認している。
おわりに
脂肪組織は採取されることによる機能障害が小さく、通常行われる脂肪吸引では吸引脂肪は日常的に廃棄されている組織である。骨髄由来幹細胞に比べて採取に伴う麻酔や倫理的問題、培養時の増殖能力(最適化により1週間で100倍に増殖させることが可能)、などで優位性があるといわれており、ASCは骨髄由来幹細胞に代わる再生医療の細胞源としての関心を集めている。間葉系幹細胞(MSC)と血管内皮前駆細胞(EPC)の双方の性質を兼ね備えている優れた細胞材料である可能性があり[7]、その応用範囲も広いと思われる。脂肪再生、骨再生、心筋再生、血管新生、難治性潰瘍などへの応用が臨床でも進みつつあり、今後の進展が期待されている。
参考文献
1. Stashower M, Smith K, Williams J, et al.: Stromal
progenitor cells present within liposuction and reduction
abdominoplasty fat for autologous transfer to aged
skin. Dermatol Surg 25: 945-949, 1999.
2. Zuk PA, Zhu M, Mizuno H, et al.: Multilineage cells
from human adipose tissue: implications for cell-based
therapies. Tissue Eng 7: 211-228, 2001.
3. Zuk PA, Zhu M, Ashjian P, et al.: Human adipose
tissue is a source of multipotent stem cells. Mol
Biol Cell 13:4279-4295, 2002.
4. De Ugarte DA, Morizono K, Elbarbary A, et al.:
Comparison of multi-lineage cells from human adipose
tissue and bone marrow. Cells Tissues Organs 174:101-109,
2003.
5. Dragoo JL, Samimi B, Zhu M, et al.: Tissue-engineered
cartilage and bone using stem cells from human infrapatellar
fat pads. J Bone Joint Surg Br 85:740-747, 2003.
6. Cowan CM, Shi YY, Aalami OO, et al.: Adipose-derived
adult stromal cells heal critical-size mouse calvarial
defects. Nat Biotechnol 22: 560-567, 2004.
7. Planat-Benard V, Silvestre JS, Cousin B, et al.:
Plasticity of human adipose lineage cells toward endothelial
cells: physiological and therapeutic perspectives.
Circulation 109:656-663, 2004.
8. Rehman J, Traktuev D, Li J, et al.: Secretion of
angiogenic and antiapoptotic factors by human adipose
stromal cells. Circulation 109:1292-1298, 2004.
Legend
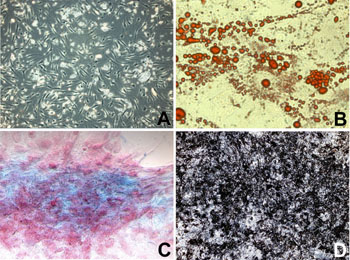
図1.吸引脂肪由来脂肪前駆細胞(間葉系幹細胞を含む)。A:細胞培養3日目の状態。B:脂肪分化誘導培地で培養後3週後の状態(オイルレッドO染色)。多くの細胞が脂肪滴を含んでいる。C:軟骨分化誘導培地で培養後3週間の状態(アルシアンブルー染色)、青色に染色されるムコ多糖類の分泌が認められる。D:骨分化誘導培地で培養後4週間の状態(フォンコッサ染色)。骨分化による石灰化が認められる。
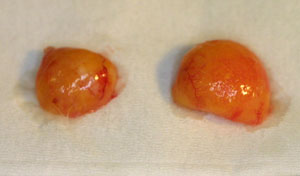
図2.ヒト吸引脂肪をSCIDマウスに移植し、4週間後の状態。左が脂肪前駆細胞を含まないもの、右は脂肪前駆細胞を混合移植したもの。
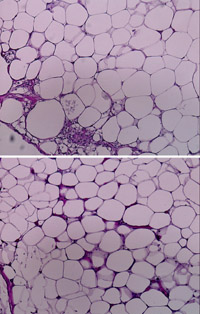
図3.ヒト吸引脂肪をSCIDマウスに移植し、4週間後の移植組織の周辺部の組織切片(HE染色、×100)。上が脂肪前駆細胞を含まないもの、下は脂肪前駆細胞を混合移植したもので新生血管が多く見られる。移植組織の中心部は、脂肪前駆細胞を含まない場合は大きな壊死組織となっている。
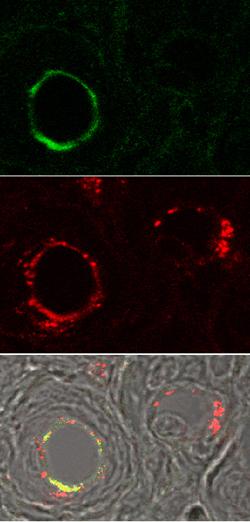
図4.GFPラット由来ASCをSDラット由来破砕脂肪とともに移植したモデルにおいて、ASCが生着・再生脂肪内の血管内皮細胞に分化している。上:抗GFP抗体染色、中:抗von
Willbrand factor(vWF)抗体染色、下:抗GFP、抗vWF染色と微分干渉像のmerge。
|

