|
はじめに
脂肪組織中の脂肪前駆細胞preadipocytes(血管間質細胞vascular stromal
cellsとも呼ばれた)の存在は古くから知られていたが、この脂肪前駆細胞に間葉系をはじめとする多分化能があることが近年指摘され1,2)、新たに脂肪由来幹細胞(脂肪由来間質細胞)adipose-derived
stem (stromal) cells (以下ASCs)とも称されるようになった。その結果、全世界で毎年100万件を超えると言われる脂肪吸引術において廃棄される吸引脂肪は、骨髄に代わる再生医療の新たな細胞源として注目を浴びるようになった。これまで多くの研究により、ヒトASCが脂肪、骨、軟骨、骨格筋、心筋、血管、肝臓などへ分化することが示されてきた3-11)。われわれも臨床応用に向けて、実際の細胞源となる脂肪吸引吸引物(liposuction
aspirates)に特に注目し、吸引脂肪を切除脂肪と比較し、また吸引物の中の、浮遊する吸引脂肪部分および下層の吸引廃液部分から採取される細胞群についてそれぞれ分析、比較し検討した12)。また、この細胞群を脂肪移植に補助的に利用する組織増大術(Cell-Assisted
Lipotransfer)を考案し13)、ASCが果たす機能について検討した。
I. 吸引脂肪(aspirated fat; lipoaspirates)と切除脂肪の比較
脂肪吸引によって得られる吸引脂肪は、径2~3mmの金属カニューレを通して陰圧(-500~700mmHg)をかけて得られる破砕された脂肪組織である。単に機械的に破砕されているだけでなく、トゥメセント吸引法により大血管や神経などを可及的に傷つけないような配慮をもって採取された脂肪組織である。すなわち、吸引脂肪は、大きな血管や神経に乏しく、その周囲の結合組織も乏しい(図1)。破砕されているがゆえに、正常脂肪組織の小片のほかに、機械的に破壊された成熟脂肪細胞も多く含まれている。これらの特徴は、光顕、電顕で、吸引脂肪と切除脂肪組織(excised
fat)とを比較検討することによっても確認することができる(図2)。
さらにそれぞれからASCを単離すると、吸引脂肪からは正常脂肪組織と比べると有意に少ない数(56±12%,
n=4)のASCしか採取されないことがわかった。すなわち、吸引脂肪組織は正常脂肪組織と比べると、幹細胞(前駆細胞)が相対的に欠乏している。吸引脂肪組織にASCが少ないことは、上記の大血管が乏しいことに加え、機械的な破砕や内因性の酵素反応などにより、吸引手術中や吸引瓶内での保存中にASCが廃液中に遊離されている可能性もある。ASCが吸引脂肪から遊離されることは、吸引廃液からもASCが単離される(後述)ことからも明らかである。組織内に前駆細胞が不足していることが、脂肪注入移植においての低生着率や移植後の脂肪萎縮の原因の1つになっている可能性がある。
II. 脂肪吸引吸引物から得られる脂肪由来細胞
a) 脂肪吸引吸引物(liposuction aspirates)
脂肪吸引で採取される吸引物は、吸引瓶の中で二層に分離される。上層は、浮遊する吸引脂肪から成り、下層は吸引廃液である(図1)。この吸引廃液は、トゥメセント液(生理食塩水、リドカイン、アドレナリンなど)、末梢血、組織破砕小片などからなる。ここでは、上層(吸引脂肪)、下層(吸引廃液)から採取された細胞成分(採取された新鮮なものをstromal
vascular fraction; SVFと呼ぶ)を、それぞれprocessed lipoaspirate
(PLA) cells、liposuction aspirate fluid (LAF) cellsと呼ぶ12)。
b) PLAとLAF
両細胞を新鮮な状態、培養した状態で比較検討した。どちらも脂肪由来細胞と血液由来細胞を含んでいるが、廃液由来のLAFの方が圧倒的に多くの末梢血由来細胞を含んでおり、脂肪吸引術中の出血量に影響を受ける。採取した新鮮細胞は、PLA細胞とLAF細胞はほぼ同数であるが、接着培養するとPLA細胞は有意に数が多い(標本により1.5から10倍)。PLA細胞はLAF細胞に比べて、脂肪由来細胞(CD45-)を多く含み、血液由来細胞(CD45+)の割合が小さい。LAF細胞は新鮮な状態でも相当数のCD34+CD45-細胞(脂肪由来細胞;大半はASC)を含んでおり、さらに培養すると、培養PLA細胞とその形態、培養倍化時間、多分化能(脂肪、骨、軟骨)、細胞表面抗原発現が酷似しており、吸引廃液にも相当数のASCが含まれていることが明らかとなった12)。
c) SVFの細胞組成
吸引脂肪、吸引廃液それぞれから採取したSVF(=新鮮PLA細胞、新鮮LAF細胞)中の赤血球を溶解バッファーで処理した後に、マルチカラーFACS(fluorescence
activated cell sorting)を用いて表面抗原の違いによりSVF中の細胞の組成を調べた。PLA、LAFにおいて、脂肪由来細胞がそれぞれ30~50%、3~15%を占め、残りを血液由来細胞が占めていた。脂肪由来細胞の大半はCD34+細胞で、その多くはASC(CD31-CD34+CD45-CD90+CD105-CD146-)であり、部分的に血管内皮(前駆)細胞(CD31+CD34+CD45-CD90+CD105lowCD146+)を含んでいた12)。ほかに血管周細胞や線維芽細胞の特徴を示す細胞が含まれていることが認められた。PLA由来SVF中の脂肪由来細胞(CD45-)の組成を表1にまとめた。
d) 培養ASCの細胞表面抗原発現の変化
ASCを接着培養すると新鮮時には発現がなかったCD105(endoglin; 間葉系幹細胞のマーカーの1つ)の発現が新たに見られるようになる12)。培養を続けるとCD34の発現は徐々に減少し、DMEMで培養していると約2週間でCD34の発現がなくなるが、培養方法によってはCD34の発現を長期的に維持することも可能である。培養PLA細胞と培養LAF細胞の主な細胞表面抗原の発現(培養1週後、4週後、10週後)を表2に示す。また、ASCは培養方法によりその表現型を大きく変えることもわかっており、Flk-1(VEGF受容体)の強い発現を誘導することも可能である14)。
e) 間葉系前駆細胞におけるASCの特徴
ASCは、皮膚線維芽細胞をはじめ、骨髄由来間葉系幹細胞(BM-MSC)、臍帯由来幹細胞など間葉系の組織前駆細胞と形態的には類似しており、またいずれも接着培養にて容易に増殖させることができる。細胞表面抗原の発現で比較すると、培養ASCは培養BM-MSCと非常に似ているが、特に新鮮時や培養期間が短い時期にはCD34の発現が培養BM-MSCに比べて非常に高い特徴を持つ。培養法によっては20回継代しても20%近い細胞でCD34発現を維持することも可能である12)。培養線維芽細胞はCD34の発現が乏しいだけでなく、CD105やCD146の発現がほとんどない点において培養ASCと明確に異なっている(図3)。
III. 脂肪組織由来細胞の組織増大術への応用
a) 吸引脂肪移植をASC(SVF)で補助する-Cell-Assisted Lipotransfer
(CAL)
前述のごとく、吸引脂肪は正常脂肪組織に比べて含有ASCが少ない。このことは吸引脂肪組織の注入移植後に移植された脂肪組織の生着や長期的な維持に不利な条件を与えている可能性がある。脂肪注入という治療法は、血行がない遊離複合組織移植であり、移植組織の部分壊死による不確実性や移植脂肪組織の萎縮、偽嚢疱や石灰化の形成などが問題とされる。しかし、移植治療において瘢痕を残さないという美容治療の観点からは絶対的長所を持っており、その欠点が解消されることの意義は非常に大きい。
移植材料のASC欠乏状態を補填する目的で、換言すればASC:adipocyte比を改善する目的で、吸引脂肪にASCを加えて接着させて、ASC-rich脂肪の状態で移植する方法を、Cell-Assisted
Lipotransfer (CAL)と命名し(図4)、実験的な検討を行った13)。
b) CALの動物実験による有効性
CALの有効性を検討する目的で、ヒト吸引脂肪に4倍量の吸引脂肪から得られるASCを加えてSCIDマウス皮下への移植実験を行った。移植脂肪はASCを加えたときに有意に大きく、特に周辺部における新生血管の違いが認められ、中心部の壊死範囲が小さかった。DiIでラベルしたASCは移植脂肪の結合組織内や成熟脂肪細胞の間に挟まれるように存在していた。移植脂肪内にはvon
Willbrand factor抗体で免疫染色されるASCが存在し、血管内皮細胞に分化していることが示唆された。同様に、GFPラット(SDラット由来)を使って、GFPラット由来ASCをSDラットの破砕脂肪と混合して移植した実験では、GFP陽性の血管内皮が認められ、やはり血管内皮細胞への分化が示唆された(図5)13)。
c) CALにおけるASCの役割
CALにおけるASCの役割は4つ考えられる。1つは、ASCが成熟脂肪細胞に分化し、移植脂肪の脂肪細胞の一部を構築すること。ラベルされた成熟脂肪細胞は実験的には認められなかったが、実際には成熟脂肪細胞の大半は蓄積された中性脂肪が占めており細胞質のラベリングは至難である。ASCは従来から脂肪前駆細胞と呼称され、成熟脂肪細胞と共培養すると脂肪細胞への分化が刺激されることが知られており15)、移植後急性期の炎症や接触している移植脂肪の刺激により脂肪細胞への分化は十分に考えられる。2つめは、ASCが血管内皮細胞へ分化し、急性期の血管新生に寄与すること。ASCが血管内皮細胞へ分化することは最近の複数の研究10,11,14)においても、またわれわれの研究においても確認された。3つめは、未分化なASCの状態で移植脂肪に存在し、前駆細胞として来たる脂肪細胞のターンオーバーに備える。われわれの研究により、本来のASCと同じように結合組織内や脂肪細胞間に存在することが確認された。正常脂肪組織はターンオーバーが遅い組織として知られているが、1.5~3年でターンオーバーしているとする報告16)も見られる。移植された脂肪組織は一時的に虚血状態(虚血-再還流障害)を受けるため、移植後の早い段階で組織がターンオーバーすることが予想される。この際に、組織内に存在する前駆細胞の働きが重要であり、術後に見られる移植脂肪組織の萎縮を最小限に抑えることが期待できる。この移植脂肪の萎縮を抑える効果は他の2つの研究17,18)からも示唆されている。4つめは、移植直後の低酸素(阻血)状態により血管新生誘導因子を放出することにより、血管新生を誘導し、移植組織の生着に寄与することである。他の研究により、ASCは低酸素状態でVEGFやHGFなどの血管新生作用を持つ増殖因子を放出することが知られている19)。こういった液性因子がパラクラインで周囲の組織に作用し、血管新生が促進されることが考えられる。
d) 移植脂肪の質的改善
既述のごとく、CALはASC:adipocyte比を上げることにより移植材料(吸引脂肪)の質的改善を目指したものである。効果は小さいが、吸引脂肪を単純に遠心することによってもASC:adipocyte比を改善することが可能である。例えば、吸引脂肪を1200gで遠心すると、水分が除かれ体積が30%減少し、12%の脂肪細胞が破壊されるが、ASCは破壊されない。結果的にASC:adipocyte比は14%改善され、単位体積あたりのASC数は43%、脂肪細胞数は25%増加する20)。この遠心脂肪に、同等量の吸引脂肪からASCを採取して加えると、計算上は最終的にASC:adipocyte比は94%改善され、単位体積あたりのASC数は143%、脂肪細胞数は25%増加することになる。
IV. CALの臨床応用にむけて
a) 細胞の臨床応用
実際の臨床応用においては安全性の観点から、可能であれば自己由来細胞で、かつ培養しない状態(minimal
manipulation)で利用することが望まれる。米国FDAは2004年11月にヒト組織・細胞由来製品の製造基準21)を制定し、この規則から除外される組織や細胞の例として、血行再建される移植臓器、minimal
manipulationされた骨髄組織、他動物由来製品、全血および血液成分、分泌もしくは抽出された製品(母乳、細胞増殖因子、コラーゲンなど:精液はのぞく)、体外での診断用製品、他家由来心臓弁・硬膜などを挙げている。製品を判断する際の項目として、①自己由来か他家由来か、②生きているか死んでいるか、③新鮮なものか一度保存されたものか、④本来の機能(homologous
use)かそれ以外の機能か、④minimalかminimal以上のmanipulationか(注1)、⑤局所で作用するものか全身に作用するものか、⑥他の薬品やデバイスと組み合わせて使用するどうか、などを挙げている。これらのどれか1つに抵触する場合は、臨床研究を行う前に、FDAの承認が必要となった。
500cc程度の吸引脂肪が採取可能であれば10の8乗個単位のASCが採取できることが想定され、新鮮細胞の状態でも実用化可能な細胞数を確保できると思われる。実際には安全性のみならず、細胞の質的な問題も生じる。ASCは培養期間が長くなるとCD34陽性細胞が減少する、HLA-A,B,Cの発現が減少する7)など、その機能的性質、表現型も変化することがわかっている。従って、再生医療のとくに初期の段階においては新鮮ASCの状態での臨床研究が主流となると推察される。
(注1) Minimal Manupilation: 細胞の生物学的・機能的性質を変えない範囲の加工行為を指す。具体例として、組織の切断・破砕・、アフェレーション(遠心による血球分離)、細胞の薬液などによる洗浄、細胞のソーティング、細胞の凍結保存、Ficollなどの密度勾配遠心分離溶液による細胞分離、ガス滅菌や放射線滅菌、などが挙げられている。
b)CALの臨床応用
我々は世界に先駆けてCAL組織増大術を臨床応用し、これまでに41症例に対して行った(平成11月現在)。内訳は、乳房が31例(豊胸23例、乳房再建4例、漏斗胸1例)、顔面10例(若返り7例、顔面片側萎縮症1例、深在性エリテマトーデスによる脂肪萎縮症2例)で、1例を除きすべて女性である。結果は非遠心脂肪を用いたものより、遠心脂肪を用いたものが良く、SVFをcell
suspensionの状態ではなく、水分を抜いた状態で加えたものが良い。組織増大効果はCell suspensionを用いた1例において移植部の彌慢性線維化を認めた以外に、大きな合併症や後遺症は見られていない。組織増大効果は大きく、移植部にも採取部にも瘢痕をほとんど残さない(図6、7)。今後も長期経過観察を慎重に続けて報告していく予定である。
おわりに
脂肪吸引で切除された脂肪組織は、組織増大目的の自家移植材料として、あるいは貴重な組織幹細胞源として利用されている。脂肪由来幹細胞は、間葉系幹細胞であるとともに、血管幹細胞であると思われる。最近、動脈の血管壁(平滑筋のすぐ外側)に血管新生に関わる幹細胞の局在が報告された22)。血管新生はあらゆる組織において不可欠であり、あらゆる組織において血管新生に関与する幹細胞が存在することは不思議ではない。広範囲の臨床分野において応用可能な血管幹細胞が吸引脂肪から採取できるとすれば、その意義は非常に大きい。脂肪を“無くす”だけでなく、“作る”、“使う”目的においても大きな進展が期待される。
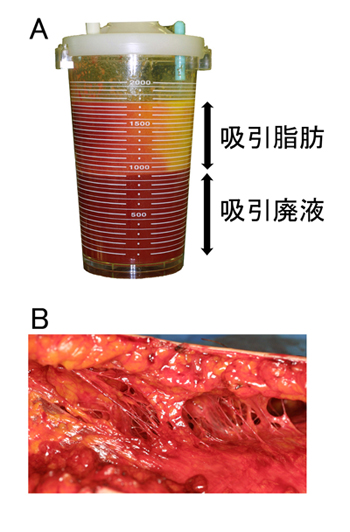
図1.脂肪吸引吸引物と吸引後の皮下組織
a. 脂肪吸引瓶に回収された吸引物:上層の浮遊物は破砕された吸引脂肪組織で、下層の吸引廃液は生理食塩水、血液、組織屑などの混合物である。
b. 脂肪吸引した後の皮下脂肪組織の状態。吸引層に蜂巣状に残っている索状物は、筋膜から皮膚に向かう大きな血管や神経を内包している。
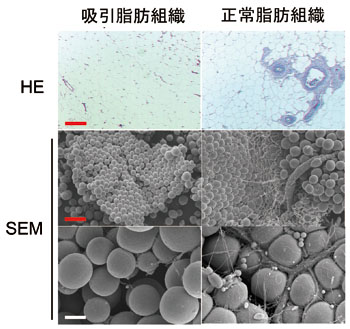
図2.吸引脂肪と切除脂肪の形態学的比較
(ともに同一患者の腹部より採取して比較;上の段はパラフィン標本のHE染色、中段、下段は走査電顕標本の弱拡大と強拡大)。基本構造はどちらもほぼ同様であるが、吸引脂肪には大血管が非常に少ない。吸引脂肪の場合は、細いカニューレにより大血管や神経を傷つけないように採取されていることによると思われる。Bar(赤)は200μm、Bar(白)は40μm。(文献13より改変)
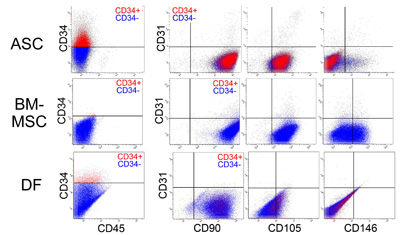
図3.培養ヒト脂肪由来幹細胞(ASC)、培養ヒト骨髄由来間葉系幹細胞(MSC)、培養ヒト真皮由来線維芽細胞(DF)のマルチカラーFACS分析
培養ASC、培養BM-MSC、と培養DFをCD34、CD45(血液細胞マーカー)、CD31(血管内皮マーカー)とさらに1つの表面抗原(CD90、CD105、またはCD146)で分析してある。形態的にはいずれも線維芽細胞様であり近似している。ASCはMSCとDFに比べて、CD34の発現が顕著であり、ASCとMSCはCD105(間葉系幹細胞のマーカーとしても使われる)やCD146(血管内皮細胞、周細胞のマーカーとしても使われる)の発現が見られる点がDFとは明らかに異なっている。CD146
は血管内皮細胞、血管周細胞マーカー。(文献12より改変)
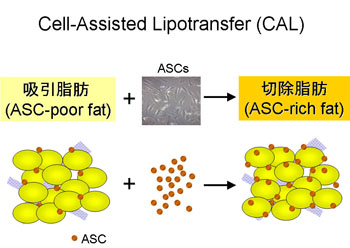
図4.Cell-Assisted Lipotransfer (CAL)の基本概念
吸引脂肪は切除脂肪に比し、含まれているASCの数が少ない。ASCが相対的に欠乏している脂肪にASCを加えて接着させることにより、ASC-rich脂肪として移植材料とする。
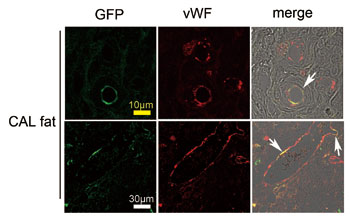
図5.GFPラット由来ASCとSDラット由来破砕脂肪との混合移植(CAL fat)(SDラットに移植されている)
CAL fat内には、血管内皮のマーカーであるvon Willebrand factor(vWF)陽性の血管内皮が認められるが、その一部はGFP陽性であり、ASCが血管内皮に分化したことを示している。血管壁全体がASC由来である血管もあれば、壁の一部の内皮がASC由来の血管も見られる。無論、宿主由来の血管も多く認められる。(文献13より改変)
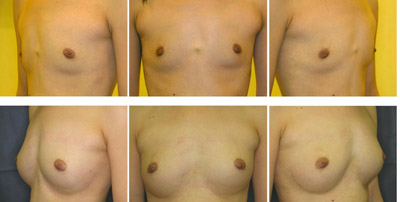
図6.CALによる豊胸術の1例
30歳、女性。術前(上)と術後12ヶ月(下)の状態。術前から軽度の胸郭変形があり、乳房の低形成を主訴に来院した。12ヶ月を経過して、触診、乳房撮影において特に異常を認めない。アンダーバストとトップバストの差は術前に比べて8.5cm増加した。(文献18より改変)
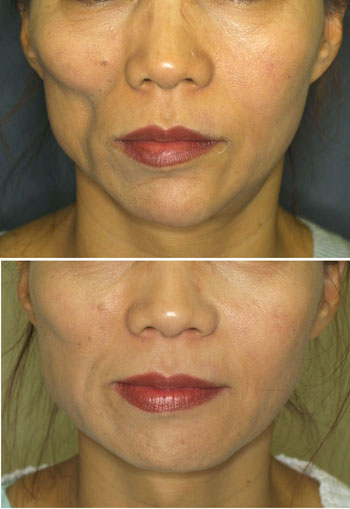
図7.CALによる顔面の組織増大術
48歳、女性。術前と術後10ヶ月の状態。深在性エリテマトーデスによる脂肪萎縮症(右頬)。陥凹部は十分に改善され、治療部位に瘢痕はない。
表1.吸引脂肪組織由来新鮮細胞群(vascular stromal fraction)の組成一覧 (文献12より改変)
吸引脂肪から採取されるSVFは、脂肪由来細胞(CD45-)と末梢血由来細胞(CD45+)から成る。脂肪由来細胞のうち、成熟脂肪細胞は処理過程で破壊もしくは廃棄される。SVFの中に含まれる脂肪由来細胞は不均一な細胞集団であるが、その大半はASCである。
注)a: adipose-derived stem cell (脂肪由来幹細胞), b: 接着培養すると+となる,
c: 仮称.
表2.培養PLAおよびLAF細胞の細胞表面抗原発現(培養後1週、4週、および10週)
新鮮な状態ではLAF細胞には多くの末梢血由来細胞が含まれており、PLA細胞とはその組成、表面抗原発現が大きく異なっているが、培養すると非常に似通っている。培養法によっては、10週間培養しても10~20%の細胞でCD34の発現は維持されている。
参考文献
1) Zuk PA, Zhu M, Ashjian P, et al.
Human adipose tissue is a source of multipotent stem
cells. Mol Biol Cell 13: 4279-4295, 2002.
2) Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells
from human adipose tissue: implications for cell-based
therapies. Tissue Eng 7: 211-228, 2001.
3) Dragoo JL, Samimi B, Zhu M, et al. Tissue-engineered
cartilage and bone using stem cells from human infrapatellar
fat pads. J Bone Joint Surg Br 85: 740-747, 2003.
4) Cowan CM, Shi YY, Aalami OO, et al. Adipose-derived
adult stromal cells heal critical-size mouse calvarial
defects. Nat Biotechnol 22: 560-567, 2004.
5) Erickson GR, Gimble JM, Franklin DM, et al. Chondrogenic
potential of adipose tissue-derived stromal cells
in vitro and in vivo. Biochem Biophys Res Commun 290:
763-769, 2002.
6) Rodriguez AM, Pisani D, Dechesne CA, et al. Transplantation
of a multipotent cell population from human adipose
tissue induces dystrophin expression in the immunocompetent
mdx mouse. J Exp Med 201: 1397-1405, 2005.
7) Miyahara Y, Nagaya N, Kataoka M, et al. Monolayered
mesenchymal stem cells repair scarred myocardium after
myocardial infarction. Nat Med: 459-65, 2006.
8) Planat-Benard V, Menard C, Andre M, et al. Spontaneous
cardiomyocyte differentiation from adipose tissue
stroma cells. Circ Res 94: 223-229, 2004.
9) Safford KM, Hicok KC, Safford SD, et al. Neurogenic
differentiation of murine and human adipose-derived
stromal cells. Biochem Biophys Res Commun 294: 371-379,
2002.
10) Planat-Benard V, Silvestre JS, Cousin B, et al.
Plasticity of human adipose lineage cells toward endothelial
cells: physiological and therapeutic perspectives.
Circulation 109: 656-663, 2004.
11) Miranville A, Heeschen C, Sengenes C, et al. Improvement
of postnatal neovascularization by human adipose tissue-derived
stem cells. Circulation 110: 349-355, 2004.
12) Yoshimura, K., Shigeura, T., Matsumoto, D., et
al. Characterization of Freshly Isolated and Cultured
Cells Derived from the Fatty and Fluid Portions of
Liposuction Aspirates. J Cell Physiol, 208: 64-76,
2006.
13) Matsumoto D, Sato K, Gonda K, et al. Cell-assisted
lipotransfer: supportive use of human adipose-derived
cells for soft tissue augmentation with lipoinjection.
Tissue Engineering, in press.
14) Cao Y, Sun Z, Liao L, et al. Human adipose tissue-derived
stem cells differentiate into endothelial cells in
vitro and improve postnatal neovascularization in
vivo. Biochem Biophys Res Commun 332: 370-379, 2005.
15) Considine RV, Nyce MR, Morales LM, et al. Paracrine
stimulation of preadipocyte-enriched cell cultures
by mature adipocytes. Am J Physiol 270: E895-899,
1996.
16) Strawford A, Antelo F, Christiansen M, et al.
Adipose tissue triglyceride turnover, de novo lipogenesis,
and cell proliferation in humans measured with 2H2O.
Am J Physiol Endocrinol Metab 286: E577-588, 2004.
17) Masuda T, Furue M, Matsuda T. Novel strategy for
soft tissue augmentation based on transplantation
of fragmented omentum and preadipocytes. Tissue Eng
10: 1672-1683, 2004.
18) Moseley TA, Zhu M, Hedrick MH. Adipose-derived
stem and progenitor cells as fillers in plastic and
reconstructive surgery. Plast Reconstr Surg 118(3
Suppl): 121S-128S, 2006.
19) Rehman J, Traktuev D, Li J, et al. Secretion of
angiogenic and antiapoptotic factors by human adipose
stromal cells. Circulation 109, 1292-1298, 2004.
20) Kurita M, Matsumoto D, Shigeura T, et al. Influences
of centrifugation on cells and tissues in liposuction
aspirates: optimized centrifugation for lipotransfer
and cell isolation. Plast Reconstr Surg, in press.
21) Department of health and human services, Food
and Drug Administration: 21 CFR Parts 16, 1271 [Docket
No. 1997N?484P] Current Good Tissue Practice for Human
Cell, Tissue, and Cellular and Tissue-Based Product
Establishments; Inspection and Enforcement. Federal
Register, 69(226): 68612-68688, 2004.
22) Zengin E, Chalajour F, Gehling UM, et al. Vascular
wall resident progenitor cells: a source for postnatal
vasculogenesis. Development, 133: 1543-1551, 2006.
|

