| a.
はじめに
肥満による脂肪組織を減量する目的の外科的治療は大きく2つに分けることができる。1つは脂肪吸引術(Liposuction)で、もう1つはBariatric
Surgeryである。前者は皮下脂肪を直接的に吸引切除する手術法であり、後者は摂取可能な食事量を減らすために胃をはじめとする消化管を外科的に形成する手術法である。脂肪吸引は肥満の治療ではなく体形の美容的改善を目的としており、肥満の多い欧米、南米をはじめ全世界で年間100万件も行われるほど広く普及している。Bariatric
Surgeryは主にBMIが40以上の重度の肥満患者を対象としているが、病的肥満の増加に伴い海外では近年急速に普及しており、その施行数は米国だけでも年間10万件を超えた1。しかし胃癌発生率の高いわが国では、消化管を切除、形成するBariatric
Surgeryはまだ一般的には行われていない。本稿では、脂肪吸引術について、また吸引切除された破砕脂肪組織を利用する脂肪移植術(脂肪注入による組織増大術)について、最近の新しい試みも含めて解説する。
b. 脂肪吸引
脂肪吸引術は、皮下脂肪を機械的に破砕したうえで吸引切除する痩身目的の美容手術で、1970年代より行われるようになった。全世界的には年間およそ100万件行われており、国内での統計はないが年間3~5万件程度と推測される。治療部位は、腹部、大腿が多く、下腿、上腕、臀部、頚部などあらゆる皮下脂肪が治療対象となる。わが国では、1から3L程度の脂肪吸引が一般的であり、体形の美容的改善は可能であるが、体重を大きく減らすことは難しい。病的肥満の多い米国などでは8Lをこえるmegaliposuctionも珍しくない2,3。大量の脂肪吸引切除によるインスリン感受性や心血管系の危険因子などへの影響の調査報告は散見されるが一致した見解は得られていない4,5。
脂肪吸引手術は、外科技術、医療器具の進歩に伴い、従来に比べて飛躍的に安全に行うことができるようになった。一般的には全身麻酔で行われるが、1L以下であれば局所麻酔で行うことも可能である。まずは皮膚の小切開(3~5mm)より脂肪組織内に金属カニューレを挿入し、予定吸引量を上回るリドカイン・アドレナリン加生理食塩水を注入し、血管収縮、鎮痛とともに脂肪組織を浮腫状とする。これにより大きな血管や神経を愛護して脂肪部分を選択的に吸引することが容易になる。吸引は3-4mmの金属カニューレ(内径2~3mm:長さ15~35cm)で持続陰圧(-500~700mmHg)をかけて行う。破砕された脂肪組織、血液、注入した生理食塩水などが吸引瓶に回収される(図1)。術後は圧迫包帯やストッキングなどで、皮下出血、炎症の自然寛解を待つ。合併症は、皮下血腫、皮膚の知覚異常、体表の凹凸などであるが、術後の一時的なものが多い。
c. 脂肪移植
1) 脂肪注入移植:脂肪吸引によって回収された破砕脂肪組織は通常は廃棄されるが、組織増大を目的として注入移植の材料や、脂肪組織由来幹細胞の採取源として利用することができる。組織増大術とは、先天的・後天的陥凹変形(あらゆる種類の脂肪萎縮症、癌切除後や外傷後の変形、漏斗胸など)に対して、また純粋な美容目的(豊胸術、ヒップリフト、顔のタルミ改善)として、自家組織や人工物を移植して局所的な体積を増やすことにより外貌を改善する治療のことである。組織増大に脂肪注入を用いる利点は、①自家組織のため異物に伴う後遺症がないこと、針による注入であるため②瘢痕を残さないこと、③形態改善の自由度が高いこと、などが挙げられる。しかし、移植後の生着率が悪い、術後移植脂肪組織が萎縮する、壊死すると嚢疱形成・石灰化などの可能性がある、などの欠点が指摘されてきた。現在、米国では顔面などに対して年間約6万件施行されている。
2) 脂肪由来幹細胞:脂肪細胞間や脂肪組織内の間質に存在する脂肪前駆細胞(preadipocyte;=間質血管細胞stromal-vascular
cell、脂肪間質細胞adipose stromal cell)は近年多分化能があることが指摘され、脂肪由来幹細胞(adipose-derived
stem cell: 以下ASC)とも呼ばれるようになった。脂肪組織は大量に(>1L)採取することが可能であるため、骨髄に代わる新たな成人幹細胞源として注目されている。脂肪吸引の吸引物から酵素処理により間質血管細胞群(stromal
vascular fraction: 成熟脂肪細胞は除かれている)を採取することができる。その細胞群の構成をFACSで分析すると表1になる(血液由来成分=CD45陽性細胞は省いてある)6。ASCは間葉系幹細胞(MSC)や皮膚由来線維芽細胞(DF)と形態的には酷似しているが、細胞表面抗原発現での一番大きな違いは培養ASCではCD34、CD105の発現が見られることである(図2)6。ASCは体内で血管内皮細胞に分化することも明らかとなり、生理的には脂肪と血管、双方の前駆細胞であると考え始められている7。
3) 吸引脂肪組織の特徴:吸引脂肪組織は細い金属カニューレで吸引されるため、大きな血管や細胞外基質が正常脂肪組織に比べて少ない(図3)8。吸引脂肪からASCを採取すると、正常脂肪組織から採取した場合の半分程度(56±12%,
n=4)の数しか回収できない(すなわち、ASCは血管の周囲に高密度に存在することが想像される)。組織内に前駆細胞が不足していることが、脂肪注入移植においての低生着率や移植後の脂肪萎縮の原因の1つになっている可能性がある。単に遠心処理を行うことにより、吸引脂肪内の一部の脂肪細胞が破壊されるがASCは残存するため、組織内のASC:adipocyte比を改善することができる(1200gの遠心で約14%)9。
4) ASCを補助的に利用した脂肪移植:我々は吸引脂肪の前駆細胞不足(低ASC:adipocyte比)を解消する目的で、別に用意した吸引脂肪から新鮮ASC(実際にはSVF)を採取して利用する治療法を開発し、Cell-Assisted
Lipotransfer (CAL)と命名した。遠心処理した吸引脂肪を生きたscaffoldとして利用し、新鮮ASCをそのscaffoldに接着させて、ASC:adipocyte比を改善した移植材料とする。CALにより移植脂肪の生着率の向上が実験的に認められ、ASCは一部は血管内皮細胞に分化し(図4)、また一部は未分化な状態で脂肪細胞間や結合組織内に存在することも明らかとなった8。ASCは移植後の短期的な血管新生に寄与すると共に、一時的な虚血の後に起こる脂肪組織のターンオーバーによる移植脂肪の萎縮を抑制することが期待された。
d. おわりに
肥満に対する決定的に有効な治療法がない現在、外科的治療法も一つの重要な選択肢と位置づけられてきている10。脂肪吸引、Bariatric
Surgeryに加え、界面活性剤や酵素剤の局所注射による脂肪組織溶解治療、炭酸ガスや蒸留水などの注入治療も試行されている。今後、肥満治療の需要の増加に伴い、外科的治療においても医療技術の改良・開発の努力が続けられるだろう。一方、脂肪吸引で切除された脂肪組織は、組織増大目的の自家移植材料として、あるいは貴重な組織幹細胞源として利用されている。脂肪を“無くす”だけでなく、“作る”、“使う”目的においても大きな進展が期待される。
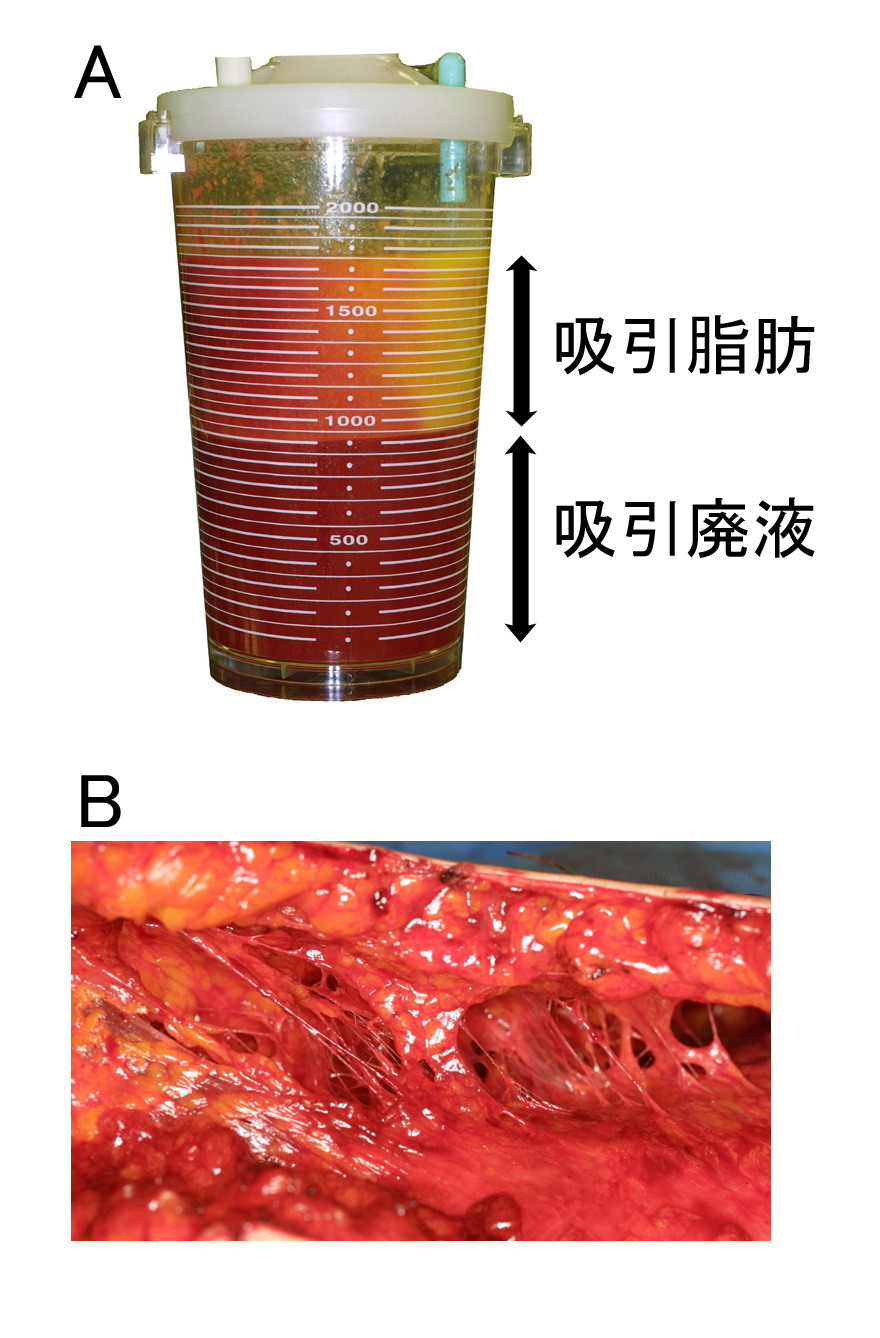
図1.脂肪吸引術
a. 脂肪吸引瓶に回収された吸引物:上層の浮遊物は破砕された吸引脂肪組織で、下層の吸引廃液は生理食塩水、血液、組織屑などの混合物である。
b. 脂肪吸引した後の皮下脂肪組織の状態。吸引層に蜂巣状に残っている索状物は、筋膜から皮膚に向かう大きな血管や神経を内包している。
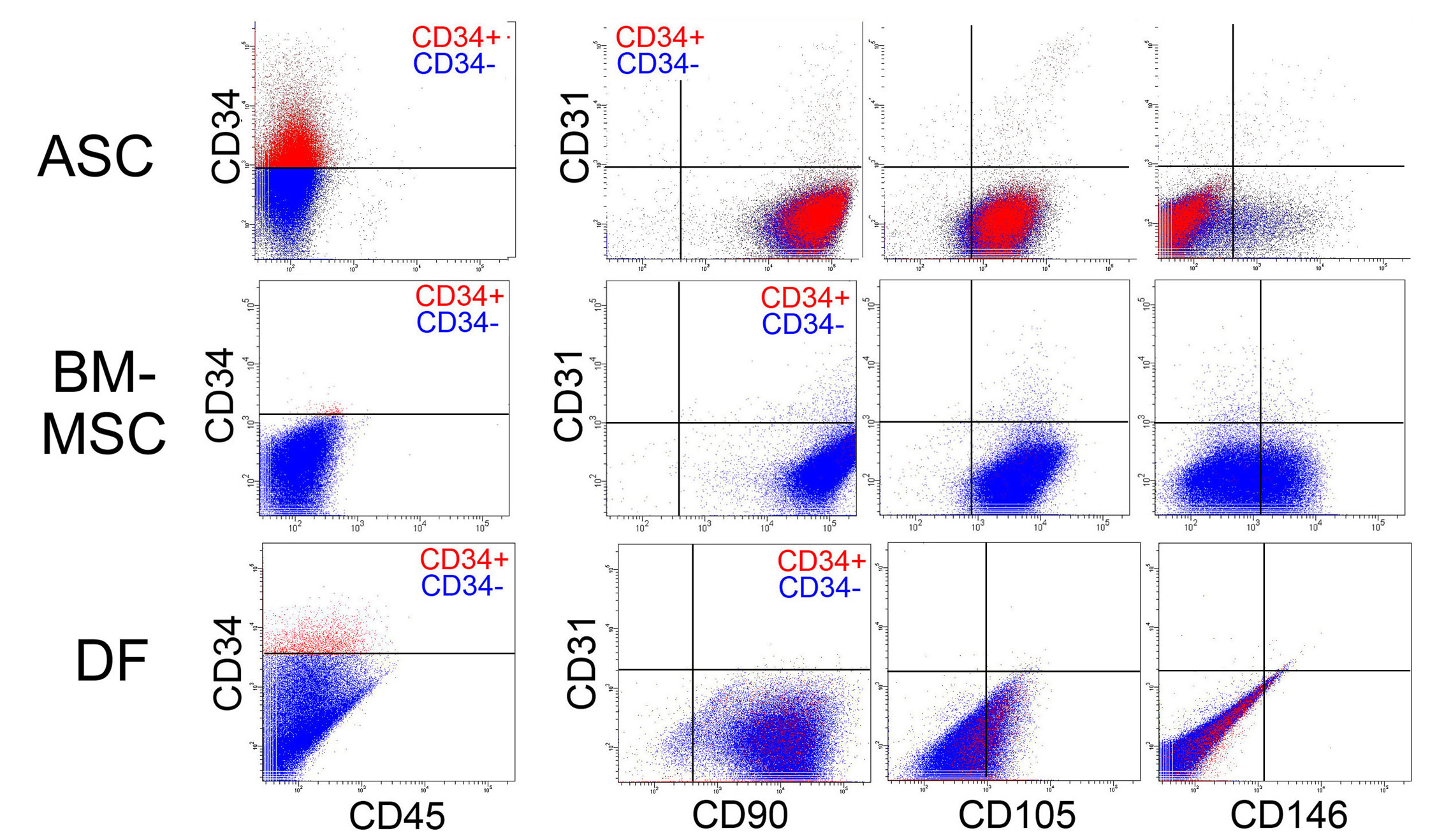
図2.ヒト培養細胞のマルチカラーフローサイトメトリー解析
ASC(脂肪由来幹細胞)、BM-MSC(骨髄由来間葉系幹細胞)、とDF(真皮由来線維芽細胞)をCD34、CD45(血液細胞マーカー)、CD31(血管内皮マーカー)とさらに1つの表面抗原(CD90、CD105、またはCD146)で分析してある。CD34は様々な組織の幹細胞で広く発現が見られる。CD146
は血管内皮細胞、血管周細胞マーカー。(文献6より改変)
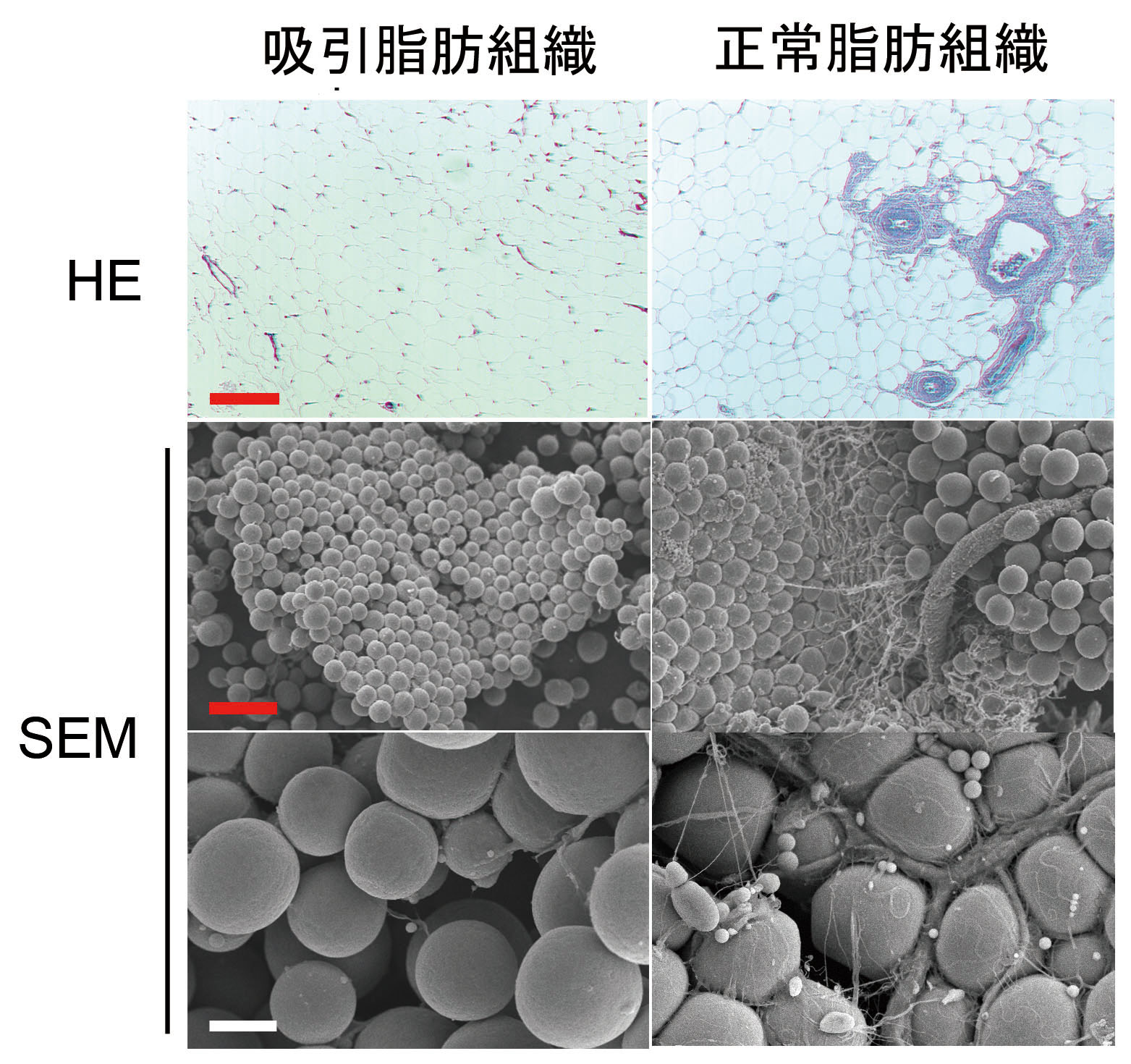
図3.ヒト吸引脂肪組織と正常脂肪組織の組織学的比較
HE染色でも走査電顕像(SEM)においても、結合組織を含む大きな血管組織が吸引脂肪組織には見られない。Bar(赤)は200μm、Bar(白)は40μm。(文献8より改変)
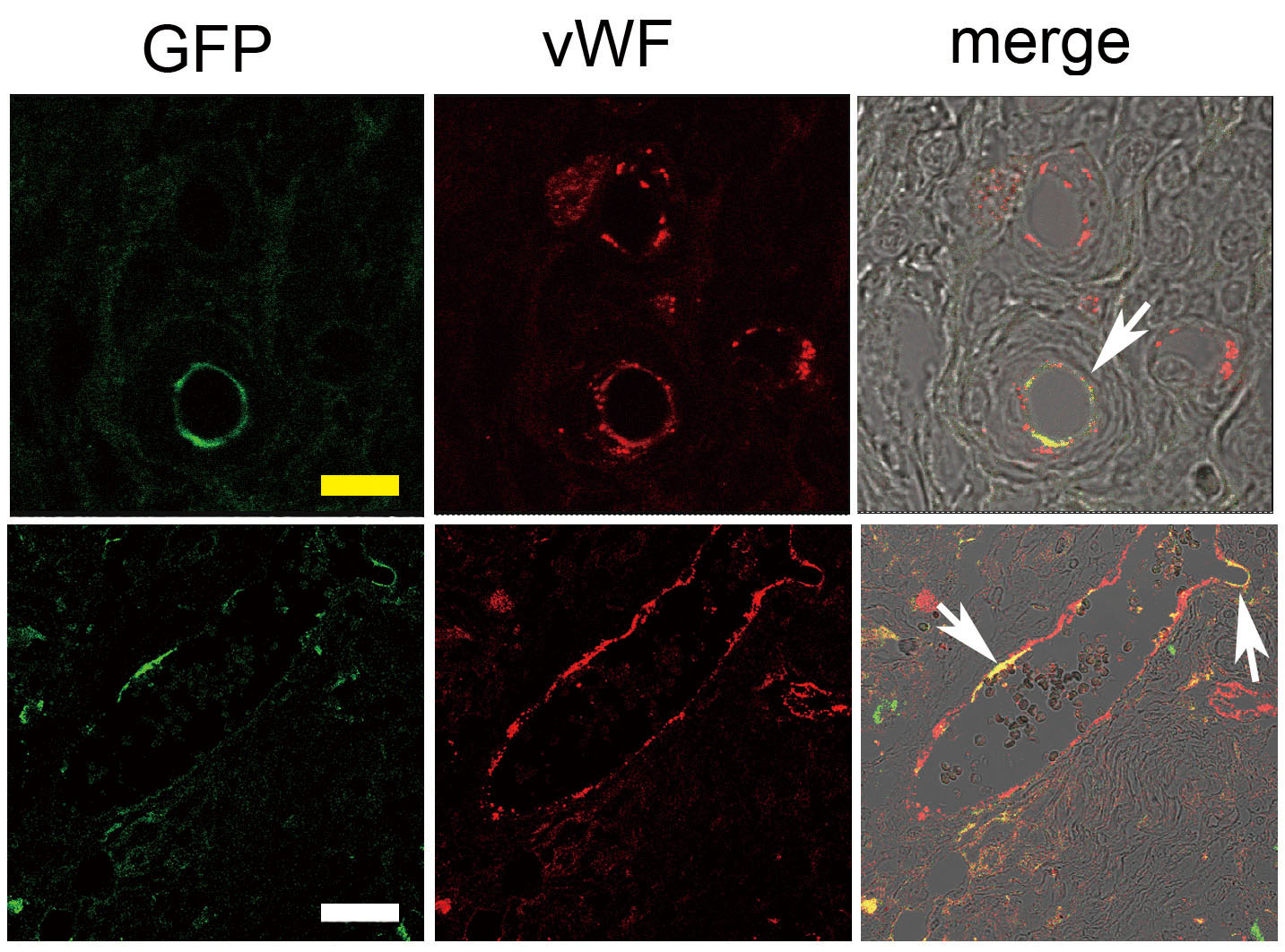
図4.CAL移植脂肪の免疫染色組織像
GFPラット由来培養ASCを対照ラット(SDラット)由来破砕脂肪と共に対照ラットに注入移植し、4週間後の移植脂肪組織を抗vWF(von
Willebrand factor)抗体(血管内皮マーカー)で免疫染色し、蛍光顕微鏡下に撮影。移植したASC由来の血管内皮細胞(矢印)が、移植脂肪内の一部の血管において、血管内皮全体もしくはその一部の内皮を構成していることが観察される。Bar(黄)は10μm、Bar(白)は30μm。(文献8より改変)
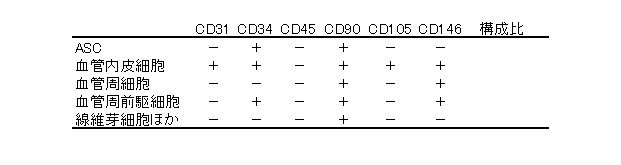
表1.吸引脂肪組織由来新鮮細胞群(vascular stromal fraction)の細胞構成(文献6より改変)
a: adipose-derived stem cell
(脂肪由来幹細胞), b: 接着培養すると+となる, c: 仮称.
参考文献
1. Steinbrook R. Surgery for Severe Obesity. N Engl
J Med, 2004, 350, 1075-1079.
2. Dhami LD, et al. Safe total corporal contouring
with large-volume liposuction for the obese patient.
Aesthetic Plast Surg, 2006, 30:574-588.
3. Commons GW, et al. Large-volume liposuction: a
review of 631 consecutive cases over 12 years. Plast
Reconstr Surg, 2001, 108, 1753-1763.
4. Klein S, et al. Absence of an effect of liposuction
on insulin action and risk factors for coronary heart
disease. N Engl J Med, 2004, 350, 2549-2557; comments
in N Engl J Med, 2004, 351, 1354-1357.
5. Esposito K, et al. Role of adipokines in the obesity-inflammation
relationship: the effect of fat removal. Plast Reconstr
Surg, 2006, 118, 1048-1057.
6. Yoshimura K, et al. Characterization of freshly
isolated and cultured cells derived from the fatty
and fluid portions of liposuction aspirates. J Cell
Physiol, 2006, 208, 64-76.
7. Planat-Benard V, et al. Plasticity of human adipose
lineage cells toward endothelial cells: physiological
and therapeutic perspectives. Circulation, 2004, 109,
656-663.
8. Matsumoto D, et al. Cell-assisted lipotransfer
(CAL): supportive use of human adipose-derived cells
for soft tissue augmentation with lipoinjection. Tissue
Eng, in press.
9. Kurita M, et al. Influences of centrifugation on
cells and tissues in liposuction aspirates: optimized
centrifugation for lipotransfer and cell isolation.
Plast Reconstr Surg, in press.
10. Bouldin MJ , et al. The effect of obesity surgery
on obesity comorbidity Am J Med Sci, 2006, 331, 183-193.
|

