| I.はじめに
全世界で毎年100万件を超えると言われる脂肪吸引術において廃棄される脂肪組織は、骨髄に代わる再生医療の新たな細胞源として近年注目を浴びるようになったが、脂肪組織を再生する需要も大きいことはあまり知られていない。脂肪組織の再生は主に美容的に陥凹や変形部位の組織の体積を増やすことを目的としており、組織増大治療と呼ばれる。その治療対象は、先天性・後天性の組織欠損や変形(漏斗胸、種々の脂肪萎縮症、癌切除や外傷による組織欠損や変形)や美容的改善(豊胸、ヒップリフトなどの体形の改善、顔面の若返りなど)である。
我々は組織増大を目的とした再生治療として、脂肪由来幹細胞(脂肪由来間質細胞)adipose-derived
stem/stromal cells (以下ASCs)を利用して、従来の脂肪移植の欠点を改良した新しい治療法(Cell-Assisted
Lipotransfer: 以下CAL)を考案した。
II. 脂肪吸引によって得られる吸引脂肪(aspirated fat;
lipoaspirates)
脂肪吸引によって得られる吸引物は、脂肪部分(吸引脂肪)と廃液部分からなる。吸引脂肪は破砕された脂肪組織からなり、廃液は血液、生理食塩水、破砕された基質部分などからなる。吸引脂肪組織は正常脂肪組織に比べて、大きな血管や細胞外基質が少ない(図1)
。これは大きな血管や神経などは体内に残すように、生理食塩水を注入した後で細い金属カニューレで柔らかい部分だけが吸引されるためである。吸引脂肪からASCを採取してみると、正常脂肪組織から採取した場合の半分程度(56±12%)の数しか回収できない1)。また、脂肪吸引によって得られる廃液成分からもASCを含む細胞群を採取することが可能である2)。ASCは正常脂肪組織内において血管の周囲に高密度に存在しており、脂肪細胞間にも散在している(図2)。以上のことから、吸引脂肪は、正常脂肪組織に比べて前駆細胞が不足している脂肪組織であることがわかる。吸引脂肪から酵素処理を経て得られる新鮮細胞群(Stromal
vascular fraction: SVF)には、血液由来細胞とともに、種々の脂肪由来細胞群が含まれている(表1)。ASCは新鮮状態においてCD31(-)CD34(+)CD45(-)CD90(+)CD105(-)CD146(-)細胞であり、培養するとCD105(+)と変化する2)。
III.ASC(SVF)を用いて移植脂肪の質的改善を図る−Cell-Assisted
Lipotransfer (CAL)
前述のごとく、吸引脂肪は正常脂肪組織に比べて含有ASCが少ない。このことは吸引脂肪組織の注入移植後に移植された脂肪組織の低生着率や移植後の脂肪萎縮の決定的な原因になっている可能性がある。脂肪注入という治療法は、血行がない遊離複合組織移植であり、移植組織の部分壊死による不確実性や移植脂肪組織の萎縮、偽嚢疱や石灰化の形成などが問題とされてきた。しかし、移植治療において瘢痕を残さないという美容的観点からは絶対的長所を持っており、その欠点が解消されることの意義は非常に大きい。
CALにおいては、移植材料のASC欠乏状態を補填する目的で、換言すればASC:adipocyte比を改善する目的で、吸引脂肪をscaffoldとしてASCを含むSVFを加えて接着させて、ASC-rich脂肪の状態で移植する(図3)。採取したSVFは培養せずにminimal
manipulationで使用されるため安全性が高い。また、大量の脂肪組織(例えば500ml)からは数億から数十億個の細胞を採取することが可能である。
動物実験では、組織増大の有効性、移植後のASCの局在、およびASCの血管内皮細胞への分化を確認した。移植脂肪はASCを加えたときに有意に大きく、特に周辺部における新生血管の違いが認められ、中心部の壊死範囲が小さかった。移植後のASCは本来と同じような局在(脂肪細胞間、および血管周囲の結合組織内)を示し、一部はvWF陽性の血管内皮細胞に分化していることが確認された(図4)1)。
また、吸引脂肪を事前に遠心処理することにより、単位体積あたりの脂肪細胞数、およびASC数をさらに増やすことが可能である。遠心により吸引脂肪内の一部の脂肪細胞が破壊されるがASCは残存し、水分が除去されるため、移植組織内の単位体積当りの脂肪細胞数、ASC数はそれぞれ25%、43%増加する(1200gの遠心の場合)
3)。
IV.CALにおけるASCの機能
CALにおけるASCの役割は4つ考えられる。1つは、ASCが成熟脂肪細胞に分化し、移植脂肪の脂肪細胞の一部を構築すること。ASCは従来から脂肪前駆細胞と呼称され、成熟脂肪細胞と共培養すると脂肪細胞への分化が誘導されることが知られており4)、移植後急性期の炎症や移植脂肪の刺激による脂肪細胞への分化は十分に考えられる。2つめは、ASCが血管内皮細胞へ分化し、急性期の血管新生に寄与すること。ASCが血管内皮細胞へ分化できることは最近の複数の研究1,5-7)において確認された。3つめは、移植直後の低酸素(阻血)状態により血管新生誘導因子を放出することにより、周囲からの血管新生を誘導し、移植組織の生着に寄与することである。ASCは低酸素状態でVEGFやHGFなどの血管新生作用を持つ増殖因子を分泌することが知られている8)。4つめは、未分化なASCの状態で移植脂肪に存在し、組織特異的前駆細胞として来たる脂肪細胞のターンオーバーに備える。ASCは移植後も、本来のASCと同じように結合組織内や脂肪細胞間に存在することが確認された。正常脂肪組織はターンオーバーが遅い(1.5〜3年)組織として知られているが9)、移植された脂肪組織は一時的な虚血状態により虚血-再還流障害を受けるため、移植後の早い段階で組織がターンオーバーすることが予想される。この移植早期のターンオーバーにおける前駆細胞(ASC)不足が術後の移植脂肪組織の萎縮に関連しているとすれば、ASCを加えることによる萎縮抑制が期待できる。この移植脂肪の萎縮を抑える効果は他の2つの動物実験10-11)からも示唆されている。
V.CALの臨床応用
我々は世界に先駆けてCAL組織増大術を臨床応用し、2003年よりこれまでに75症例に対して行った(平成19年5月現在)。内訳は、乳房が73例(インプラントからの入れ替えを含む豊胸63例、乳房再建8例、漏斗胸2例)、顔面13例(若返り10例、顔面片側萎縮症1例、深在性エリテマトーデスによる脂肪萎縮症2例)、臀部1例で、1例を除きすべて女性である。
治療法は、まず採取した吸引脂肪の約半分と吸引廃液よりSVFを採取する(約90分)。残りの吸引脂肪に新鮮SVFを加えて患部に注入移植する。これまでに3通り(A:非遠心吸引脂肪にSVFをcell
pelletとして加える、B:まず非遠心脂肪を移植し、そのあとで別にSVFをcell suspensionとして注入、C:遠心脂肪にSVFをcell
pelletとして加えて接着させる)を試みた。豊胸術の場合で、移植脂肪の体積は左右各250-300ml、手術時間は約4時間である。最高42ヶ月の経過観察を行った。
結果は非遠心脂肪を用いたものより、遠心脂肪を用いたものが良く、SVFをcell suspensionとして別に注入するのではなく、cell
pelletとして脂肪に接着させて移植したものが良い。患者の満足度は高く、組織増大効果は全例において認められた(図5)。豊胸術の場合でその増大効果は100-200mlであった。副作用としては、cell
suspensionを用いた1例において移植部の彌慢性線維化を認めた。また3例にmicrocalcificationを認め、さらに4例において嚢疱形成(すべて12mm以下)を認めた。Preliminaryな臨床結果を報告したが12)、昨年より組織増大量の3次元定量測定システムを導入し、今後も長期経過観察を続けて定量解析を報告していく予定である。
VI.おわりに
脂肪吸引で切除された脂肪組織は、組織増大目的の自家移植材料として、あるいは貴重な組織幹細胞源として利用することができる。脂肪由来幹細胞は、間葉系幹細胞であるとともに、血管幹細胞であると思われる。最近、動脈の血管壁(平滑筋のすぐ外側)に血管新生に関わる前駆細胞の局在が報告されたが13)、脂肪幹細胞の一部と全く同じ局在であると思われる。広範囲の臨床応用が可能な血管幹細胞が吸引脂肪から採取できるとすれば、その意義は非常に大きい。
参考文献
1) Matsumoto D, Sato K, et al.: Tissue
Eng 12, 3375-3382, 2006.
2) Yoshimura K, Shigeura T, et al.: J Cell Physiol
208, 64-76, 2006.
3) Kurita M, Matsumoto D, et al. Plast Reconstr Surg,
in press.
4) Considine RV, Nyce MR, et al.: Am J Physiol 270,
E895-899, 1996.
5) Planat-Benard V, Silvestre JS, et al. Circulation
109, 656-663, 2004.
6) Miranville A, Heeschen C, et al. Circulation 110,
349-355, 2004.
7) Cao Y, Sun Z, et al. Biochem Biophys Res Commun
332: 370-379, 2005.
8) Rehman J, Traktuev D, et al. Circulation 109, 1292-1298,
2004.
9) Strawford A, Antelo F, et al. Am J Physiol Endocrinol
Metab 286, E577-588, 2004.
10) Masuda T, Furue M, et al. Tissue Eng 10: 1672-1683,
2004.
11) Moseley TA, Zhu M, et al. Plast Reconstr Surg
118(3 Suppl): 121S-128S, 2006.
12) Yoshimura K, Sato K, et al. Aesthetic Plast Surg,
in press.
13) Zengin E, Chalajour F, et al. Development 133,
1543-1551, 2006.
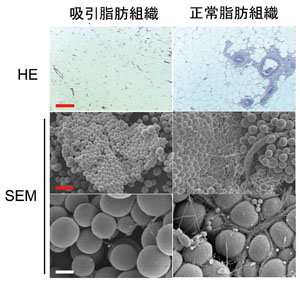
図1.吸引脂肪と切除脂肪の形態学的比較
(ともに同一患者の腹部より採取して比較;上の段はパラフィン標本のHE染色、中段、下段は走査電顕標本の弱拡大と強拡大)。基本構造はどちらもほぼ同様であるが、吸引脂肪には大血管が非常に少ない。吸引脂肪の場合は、細いカニューレにより大血管や神経を傷つけないように採取されていることによると思われる。Bar(赤)は200μm、Bar(白)は40μm。(文献1より改変)
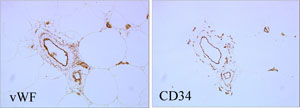
図2.脂肪組織内におけるASCの局在
正常脂肪組織のvon Willbrand factor (左)、CD34(右)免疫染色像。血管内皮細胞(CD34陽性vWF陽性細胞)は血管の最内層と脂肪内のcapillaryに見られ、ASC(CD34陽性vWF陰性細胞)は血管平滑筋の直外側に多数認められる。このほか、ASCは脂肪細胞間にも散在する。

図3.Cell-Assisted Lipotransfer (CAL)の基本概念
吸引脂肪は切除脂肪に比し、含まれているASCの数が少ない。そこで、SVF採取用に余分に脂肪を採取する。ASCが相対的に欠乏している吸引脂肪をscaffoldとしてASCを接着させることにより、ASC-rich脂肪として移植材料とする。(文献12より改変)
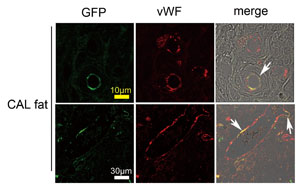
図4.GFP-SDラット由来ASCとSDラット由来破砕脂肪との混合移植(CAL fat)(SDラットに移植されている)
CAL fat内には、血管内皮のマーカーであるvon Willebrand factor (vWF)
陽性の血管内皮が認められるが、その一部はGFP陽性であり、ASCが血管内皮に分化したことを示している。血管壁全体がASC由来である血管もあれば、壁の一部の内皮がASC由来の血管も見られる。(文献1より改変)
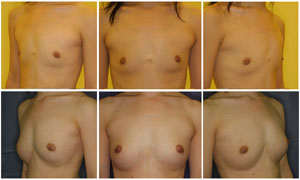
図5.CALによる豊胸術の1例
30歳、女性。術前(上)と術後24ヶ月(下)の状態。術前から軽度の胸郭変形があり、乳房の低形成を主訴に来院した。24ヶ月を経過して、触診、乳房撮影、MRIにおいて特に異常を認めない。アンダーバストとトップバストの差は術前に比べて8.0cm増加した。(文献12より改変)
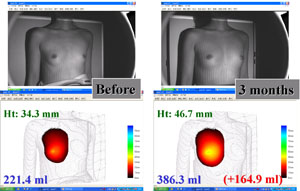
図6.CALによる豊胸術における乳房体積3次元測定
23歳、女性。270mlのCALによる豊胸術を行なった。術前(左)と術後3ヶ月(右)の状態。立位において、3点の基準点により定義される標準平面より手前の体積を測定することが可能である。乳房の高さは12.4mm増加し、乳房の体積は164.9ml増加していることがわかる。
表1.吸引脂肪組織由来新鮮細胞群(stromal vascular fraction)の細胞構成 (文献2より改変)
吸引脂肪から採取されるSVFは、脂肪由来細胞(CD45-)と末梢血由来細胞(CD45+)から成る。脂肪由来細胞のうち、成熟脂肪細胞は処理過程で破壊もしくは廃棄される。SVFの中に含まれる脂肪由来細胞は不均一な細胞集団であるが、その大半はASCである。
CD31 CD34 CD45 CD90 CD105 CD146
構成比
(平均±標準誤差)
ASCa − + − + −b − 71.0 ± 5.7%
血管内皮細胞 + + − + + + 7.3 ± 2.1%
血管周細胞 − − − + − + 3.8 ± 1.6%
血管周前駆細胞c − + − + − + 0.5 ± 0.1%
線維芽細胞ほか − − − + − − 17.4 ± 4.9%
a: adipose-derived stem cell (脂肪由来幹細胞), b: 接着培養すると+となる,
c: 仮称.
|

